キレート滴定にはキレート試薬、緩衝液、金属指示薬(Metal indicator)などが必要である。 いま、水溶液中で、金属イオンMとキレート試薬Zが反応すると、水溶性の金属キレート化合物MZxを生成し、 M + xZ ⇔ MZx Mに対応するZの量からMが定量される。過滴加 mL 1 mL 計算式 (DB)*K*F*M/S 最大滴加mL 40 mL 小数点以下桁数 4 滴定液名 01M EDTA 電極名 自動入力先パラメータ 無し 5.摘要 (1)測定条件について(2)容量分析(キレート滴定,酸化還元滴定,中和滴定,沈殿滴定)を実験できる。 (3)報告書(レポート)の作成方法を実践できる。 第2学年 物質工学科 履修 2単位 必修 実験 到達目標 ② 容量分析のキレート滴定・ 酸化還元滴定・中和滴定・ 沈殿滴定の類似点と
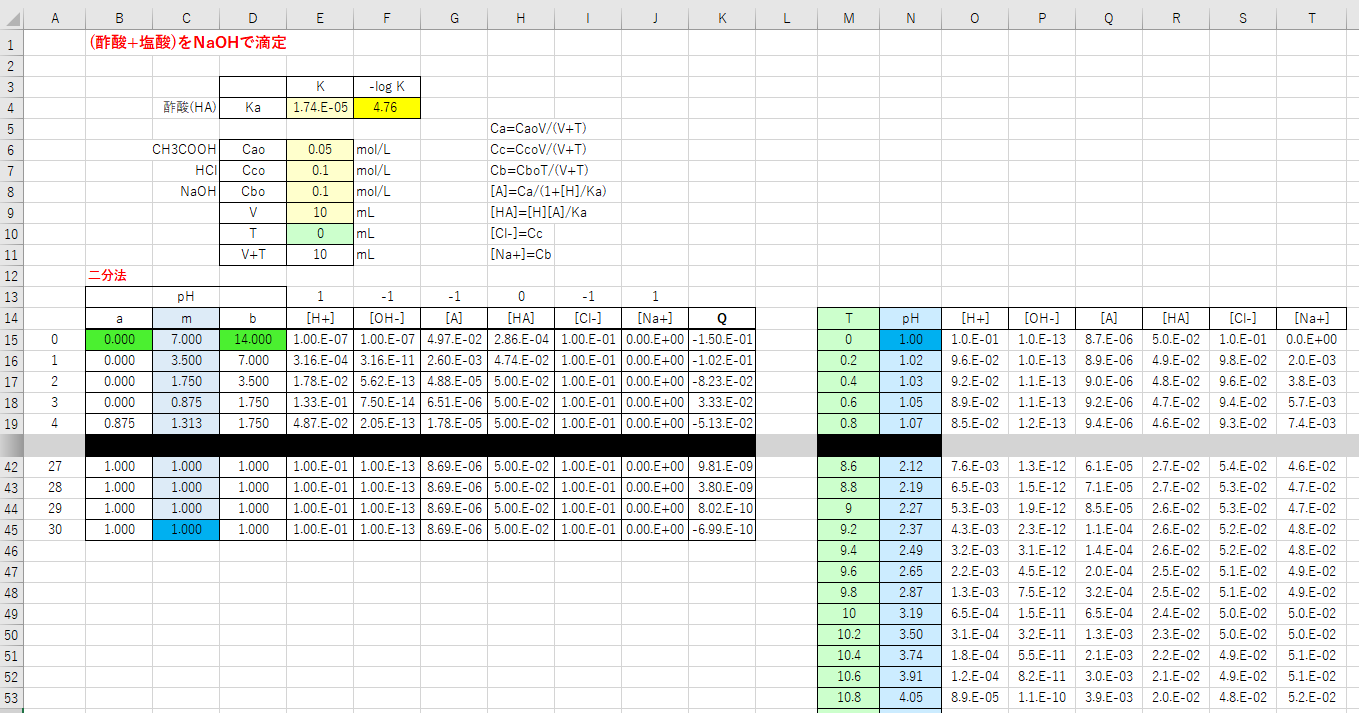
滴定曲線 滴定曲線 溶解度などーエクセルを用いて
キレート滴定 計算方法
キレート滴定 計算方法-水道水のカルシウム硬度測定はキレート滴定(光度検出)で行います。 滴定の種類:キレート滴定(光度検出) 参考規格・文献 上水試験方法 硬度 計算 式水の硬度測定 水の硬度とは、水に溶けているCa2+およびMg2+ の量をCaCO 3(ppm )に換算した ものである。硬度には、全硬度(Ca2+とMg2+),Ca硬度,およびMg硬度がある EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イ



薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download
· その方法として、次のような手順が取られます。 EDTA法(指示薬:EBT)によりCa、Mg量をまとめて測定する。 EDTA法(指示薬:NN)によりCa量だけを測定する。 Mg量は①‐②で求まる。 総硬度を計算する。 ①は上記に示した通り、Ca、Mgを区別せずに測定します。8 キレート滴定の原理を理解し,金属イオン濃度に関する計算ができる. 14週 酸化還元平衡と酸化還元滴定(1) 9 ネルンスト式を用いて平衡電位に関する計算ができる. 15週 酸化還元平衡と酸化還元滴定(2) 10 酸化還元滴定の原理を理解し,酸化剤原子吸光用Ca標準液を用いた硬度の測定 登録日: 12年07月19日 最終回答日:12年08月01日 水・土壌環境 その他(水・土壌環境) No 1719 ZWlad13 jisanmieko
#中和 #水酸化ナトリウム #計算 #公式坪田塾|名古屋市で評判の「子」別指導学習塾 http//tsubotajukucomEDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合し、安定なキレート化合物を生成する。 この反応を利用した金属イオンの定量法をキレート滴定法という。 (キレートとはカニのはさみの意味) なお、EDTAは水にほとんど溶けないため、キレート滴定では水に溶けやすいEDTA・2Naを用いるト滴定法は,エチレンジアミン四酢酸 (EDTA)及びその類縁体が,多くの金属イオンと価数に依らず1:1のキレート錯体 を形成することを利用した金属イオンの容量分析法である。 この方法は,主にCa2 +及びMg2+の滴定法(水の硬度の測定)として知 られさているが,適当な条件と金属指示薬の使用によって多くの金属イオンのmg/Lレベ ルでの定量が可能である
今回は食品添加物公定書に収載されている「カルシウム塩定量法」の方法を一例にカルシウム塩のキレート滴定について紹介する。 2 キレート滴定 キレート滴定はキレート試薬が金属イオンと錯体 (キレート)を形成することを利用して金属イオン濃度を キレー ト滴定法は, 金属キレー ト錯体の生成反応を利用して,金属イオンを定量する方法である。 たとえば,水道水など飲料水中に含まれるマグネシウムおよびカルシウムイオン濃度, すなわち,水の硬度はEDTAを用いるキレー ト滴定によって簡単に測定できる。EDTA の他にも多数のキレート滴定剤および指示薬が開発され,大部分の金属イオンが滴定法によって定量できるようになった。5.滴定結果より、試料溶液250ml中に存在するCaの重量を計算する。 1)MgEDTA溶液の調整 Mg(NO 3 ) 2 ・6H 2 Oのごく少量をビーカーにとり、水に溶解して約 mlとし、pH




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




Mbaheblogjpxy1z 無料でダウンロード キレート滴定 Ph キレート滴定 Ph 理由
0707 · 投稿日:7月 7, こんにちは、trans (トランス)です。 今回は、キレート滴定法を用いて、水道水と飲料水の硬度を算出する実験について紹介します。 まず、硬度の章では、硬度とは何か,飲料水の硬水と軟水の違いなどを紹介します。 次に、キレート滴定の章では、キレート滴定の基本的な原理,金属指示薬とpHの関係,硬度を求める方法などについて3 標準物質、標準溶液、滴定、ファクターについて理解し、説明ができる。 4 溶液のpH、中和滴定の計算ができる。 5 酸化剤、還元剤、酸化還元反応について理解する。酸化還元反応に関する計算ができる。 6 沈殿滴定とキレート滴定について説明できる。 · キレート滴定でミネラルウォーターに含まれるCa2とMg2の濃度の和(mol/L)を求めたのですが、ここから硬度を計算する方法がわかりません。 濃度(mol/L)×5608(CaOの式量)× (100/1000)(ml)×1000(mg)=硬度(度)




Wo00 号 アルミニウムキレート化合物およびビヒクル用増粘剤 Astamuse



キレート滴定法のマイクロスケール化
1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。 また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。 2.原理 金属イオンに配位し、キレート化合物を形成する多座配位子をキレート試薬と呼ぶ。化学 キレート滴定において キレート滴定の実験において 塩化アンモニウム70gに比重090の濃アンモニア水を加え、さらに水を加え1リットルにした という手順で緩衝液を調整しました。 調整自体 質キレート滴定は、中和滴定などのようなイオン反応とは異なり反応が遅 いので、終点近くでは特に1 滴あるいは半滴ずつ滴下し、色の変化に注意 せよ。同様の滴定を3 回以上行う。 各実験台毎に各種滴定法で必要な器具・試薬を配布します。




Wt からvol へ変換できますか ジグザグ科学 Com



カールフィッシャー水分測定試薬 アクアミクロン 分析 製品情報 試薬 富士フイルム和光純薬
質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法キレート滴定による銅と亜鉛の定量 調整した真鍮の試料溶液5cm3を001mol/L EDTA標準溶液で3回滴定を行った。 3回の滴定の平均は95mlであった。 Cu2+とZn2+のいずれもが、それぞれ1:1でEDTAとキレート化合物を作る1)ので、 · EDTA溶液の濃度(mol/l)×EDTA溶液の滴定値(ml)=Ca2とMg2の濃度の総和(mol/l)×試料量(ml) (式) × 3005 = x × 50 = 50x x = (mol/l)
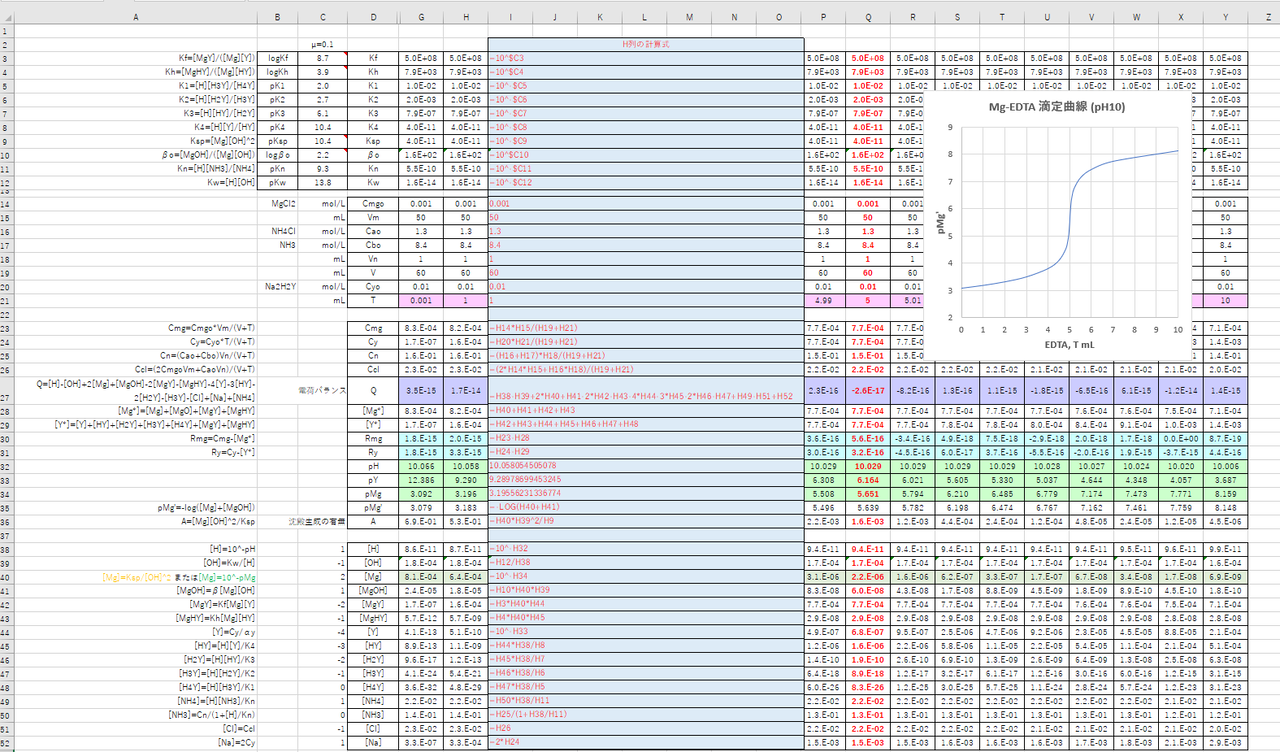



年05月 滴定曲線 溶解度などーエクセルを用いて



キレート滴定法のマイクロスケール化
キレート 滴定法で土壌中のカルシウム濃度が簡便に測定する ことが確認できたので,今後サンプル数を増やして データを取得していきたい。 3.結論 ①本実験では二酸化炭素を添加した水への炭酸カル シウムの溶解度が大きくなることがキレート滴定に容量分析実験では,キレート滴定により水道水中のMg 2 とCa 2 を定量する. Mg 2 の定量手順 この方法では,試水にMg 2 とCa 2 が含まれるときは,その総量が定量される. 4の滴定液の標定については,「MgCl 2 標準溶液によるEDTA滴定液の標定」を参照水道水と飲料水の硬度測定 ~硬度,キレート滴定,マスキング 硬度の計算方法を教えてください。水1L中にCaが16mg、Mgが 硬度 (水) Wikipedia
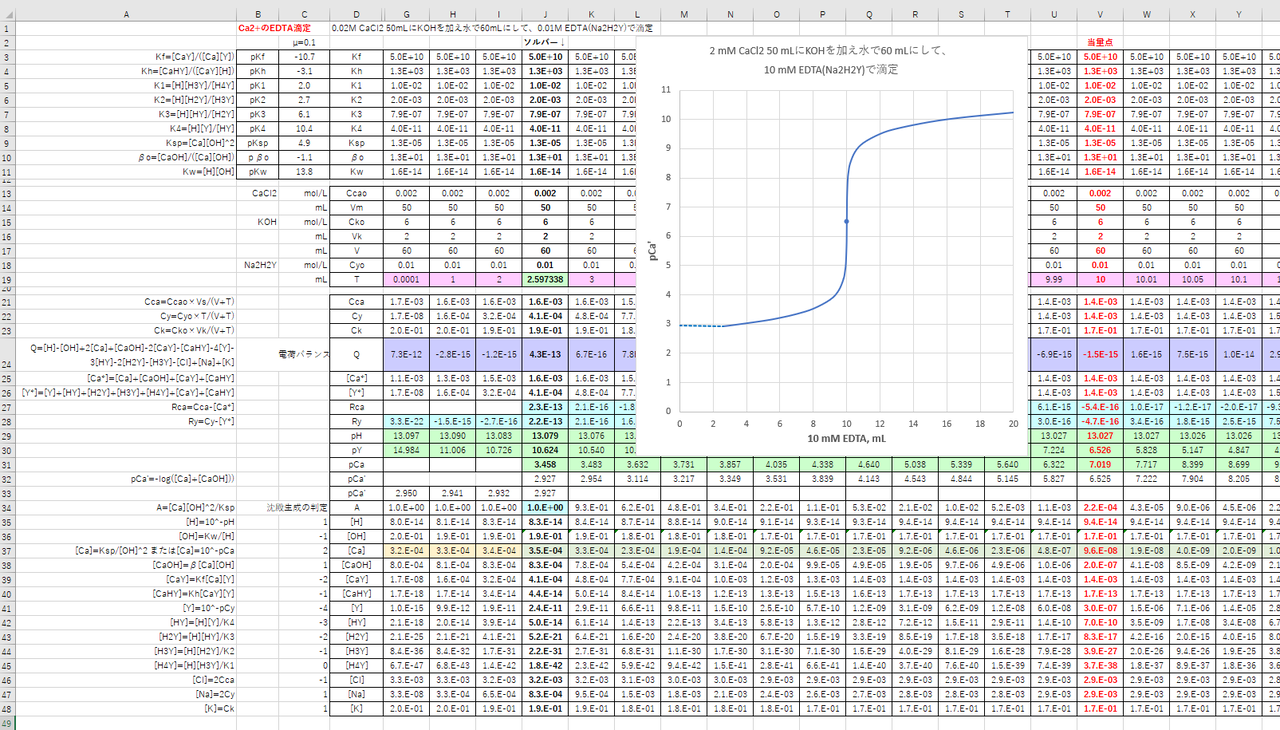



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて




17 号 可搬型滴定装置 Astamuse
また、本滴定は指示薬の変色が完結した点を終点とするため、終点検出はB 交点検出に設定しま す。 (2)その他の滴定方法について 亜鉛イオンのキレート滴定には、各種の指示薬およびpH 領域での滴定方法があります。 ① 指示薬 · キレート滴定法のほか、icp 発光分光分析法も硬度の測定方法の一つです。icp 発光分光分析法は、プラズマ に導き入れた試料中のカルシウム等が発する光を測定して、その濃度を求める方法です。ではプラズマとは何で しょうか。水道水の総硬度測定はキレート滴定 ⑥ EBT指示薬溶液0.5mlを加え、0.01mol/L-EDTA溶液で滴定します。(赤→青) 計算 10W/V%-シアン化カリウム溶液使用時は、取扱い方法や試薬の保管などに充分ご注意下さい。




ミネラル サプリ キレート 滴定




沈殿滴定 水道水中の塩化物イオン ファヤンス法 モール法 Transblog
· EDTAはCa2と1:1で結合するので、「滴定終点までに加えたEDTAの物質量(mol)= 25mLの水に含まれるCa2の物質量(mol)」ということになります。 EDTA溶液の濃度をC (mol/L)、滴定終点までに加えた体積をa (mL) とすると、その中に含まれるEDTAの物質量はC×a/1000。XIII31 化学的方法 (1)金属指示薬 Metal Indicators 金属イオンを検出する指示薬のこと それ自身キレート試薬である有機試薬。 pM 指示薬 ともいう。 金属指示薬の条件 ①滴定条件で遊離型指示薬とキレート型指示薬の色調のコントラストが大きい。秤量瓶に上皿天秤(電子天秤)を使って、EDTA・2Naを約0.9g採取する。 分析天秤で、EDTA・2Naを入れた秤量瓶の質量を精秤する。 あらかじめ、100mlビーカーに純水を約60ml入れておき、その中に採取したEDTA・2Naを洗い落とし、かくはんして溶解する。 純水で秤量瓶を2回以上すすぎ、秤量瓶中にEDTA・2Naが残らないようにする。 ロートとロート台を用い、250mlメス




滴定曲線 滴定曲線 溶解度などーエクセルを用いて




分析実務たん Jis準拠 数式を書くのが面倒なので手書きで
キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。キレート滴定の計算方法 1 試薬の体積と初濃度 塩化アンモニウムNH 4 Cl-アンモニア水NH 3 系のpH緩衝液により,常にpH=10一定であると仮定する.計算を簡単化するために,カルシウムイオンCa 2 やマグネシウムイオンMg 2 と指示薬のエリオクロムブラックT(EBT)の錯体形成反応(化学平衡)を無視する. · キレート滴定 1、目的 EDTAを用いるキレート滴定により、EDTAの濃度を求める。さらにそれを利用して濃度未知のCaCO3溶液の濃度を求める。 2、装置・器具・試薬 250mlメスフラスコ,250ml試薬びん,100mlメスシリンダー,10mlホールピペット,2ml駒込ピペット,0mlコニカルビーカー3個,ビュレット




エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com




1999 1017号 滴定制御方法 Astamuse
· キレート滴定の硬度の計算について考えています。 ミネラルウォーター50cm3を試料にedta溶液でキレート滴定をしたのですが、 硬度の計算がわからなかったため、知恵袋で検索していたところ、方法が2つキレート滴定 エチレンジアミン四酢酸(edta、h 4 yと略記)は、水溶液中で金属イオンと反応し、 非常に安定な金属キレート化合物を作る。 キレート滴定は、そのことを利用した容量分析法である。キレート生成反応は、 である。(試料水 + koh水溶液 + nn指示薬)をedta溶液で滴定する。 なお,「実験の手引き」にも記載のとおり,キレート滴定におけるマイクロビュレットの 目盛の読み方,ホールピペットの操作,器具類の洗浄の仕方(純水洗い,共洗い),滴定の終




硬度1500mg Lのかた い水がある 水の硬度測定 バイオ科 応用バイオ化学実験 分析化学 2年 036 ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ
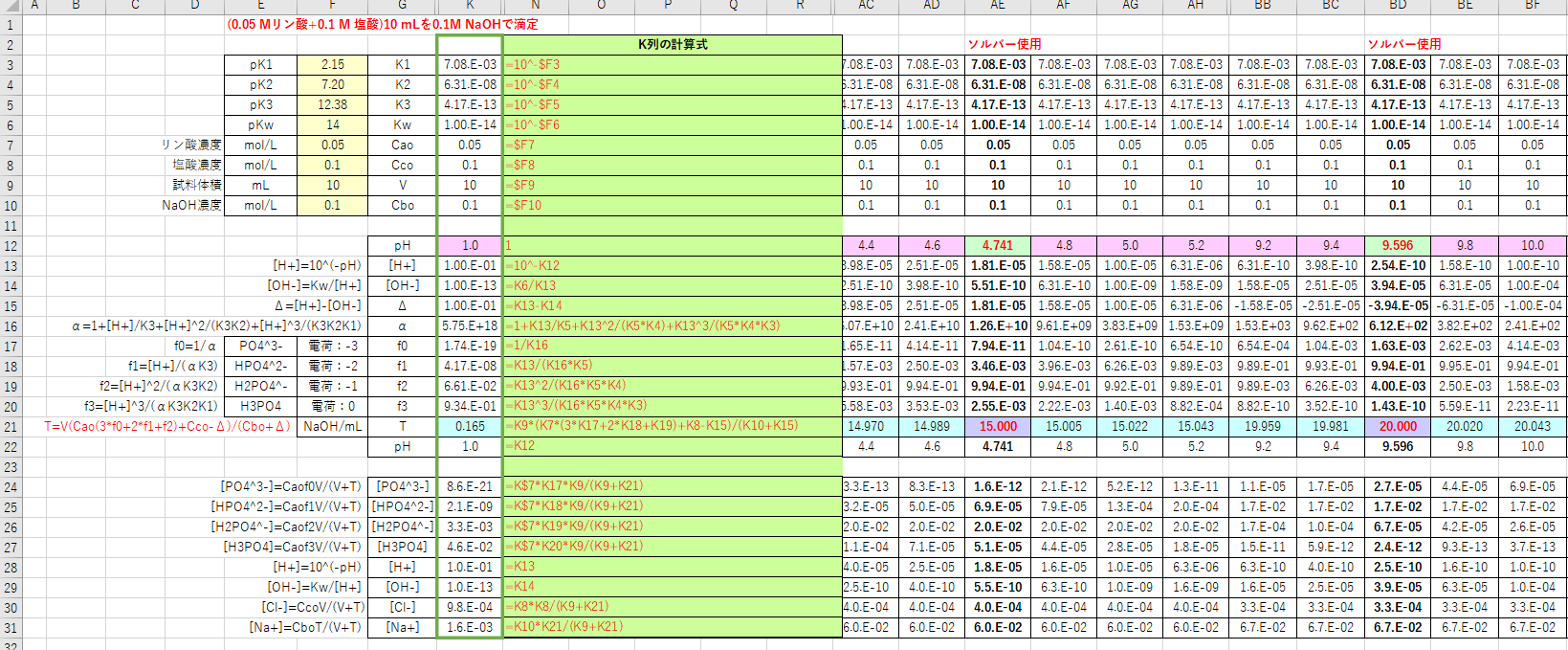



滴定曲線 滴定曲線 溶解度などーエクセルを用いて
京都大学 化学実験操作法:操作法 2 4 キレート滴定 -Mg イオンの定量-滴定し,引 き続きph55に おいて,鉛カ ドミウムを 滴定する滴 定終了後,フ ェナントロリンを添加すると カドミウムのみフェナントロリンと反応するので,遊 離 したedtaを 鉛標準液で逆滴定し,カ ドミウムを定量 する方法が発表されているり 2・4 チオール問題28 キレート滴定法による銅と亜鉛の定量 合金は、日々の生活の様々な場面で使用されている。とりわけ、その特性(たとえ ば伝導性,機械的特性あるいは耐食性など)により、合金は航空学,建
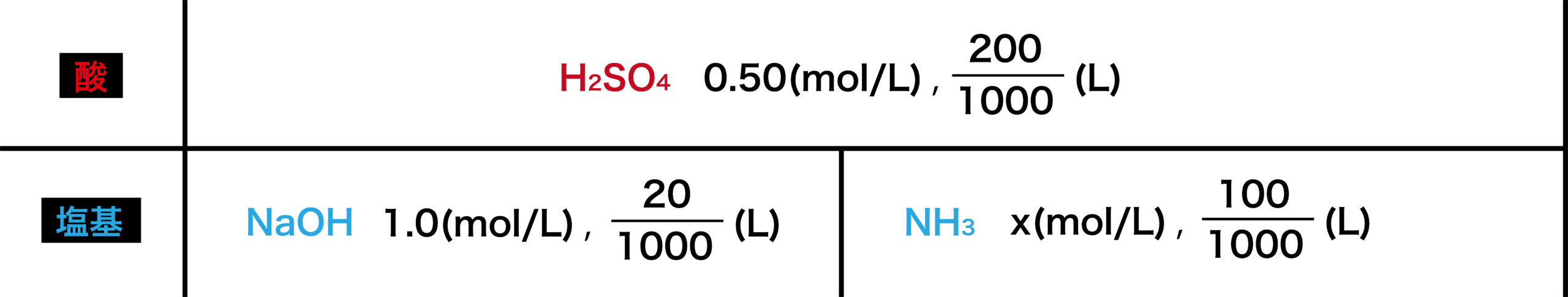



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ




Images Of キレート滴定 Japaneseclass Jp
例えば, mol/LのEDTA水溶液を用いて,検水0 mLを滴定したところ,130 mL加えたところで反応が完了したならば,硬度 = 100××130×1000÷0 = 650 ということになる。 5 実験(5) 滴定・終点操作 (ア) 手際よく滴定操作ができている。 (イ) 終点の判断が適切である。 3 完成度・結果について 1 報告書 (1) 反応式・計算式など必要なものが記入されている。 (2) 反応式に基づいた計算が正しくされている。 (3) 誤差を考慮している。
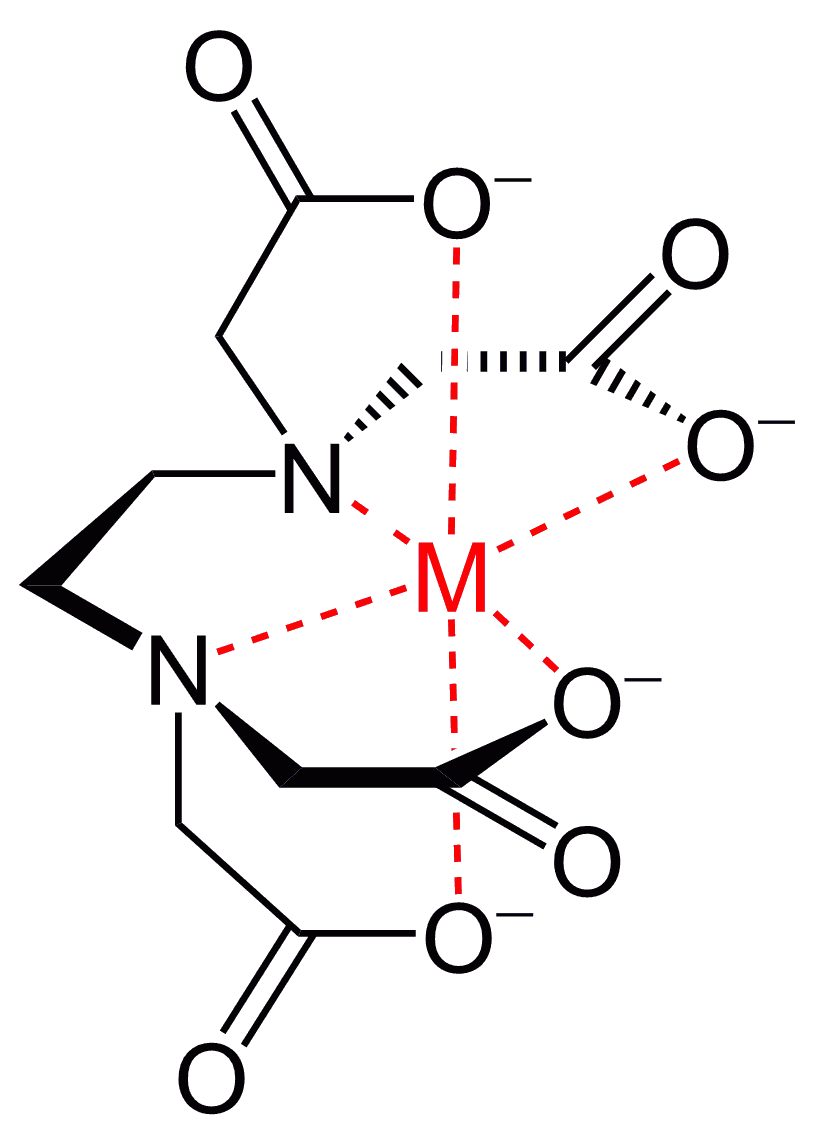



キレート Wikipedia




薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




国際化学オリンピックに挑戦 5 実験 国際化学オリンピックobog会 本 通販 Amazon




キレート滴定法の意味 用法を知る Astamuse




Dviout 酸と塩 Pdf 無料ダウンロード




滴定の解説 イプロスモノシリ モノシリ 製造業技術用語集




17 号 可搬型滴定装置 Astamuse
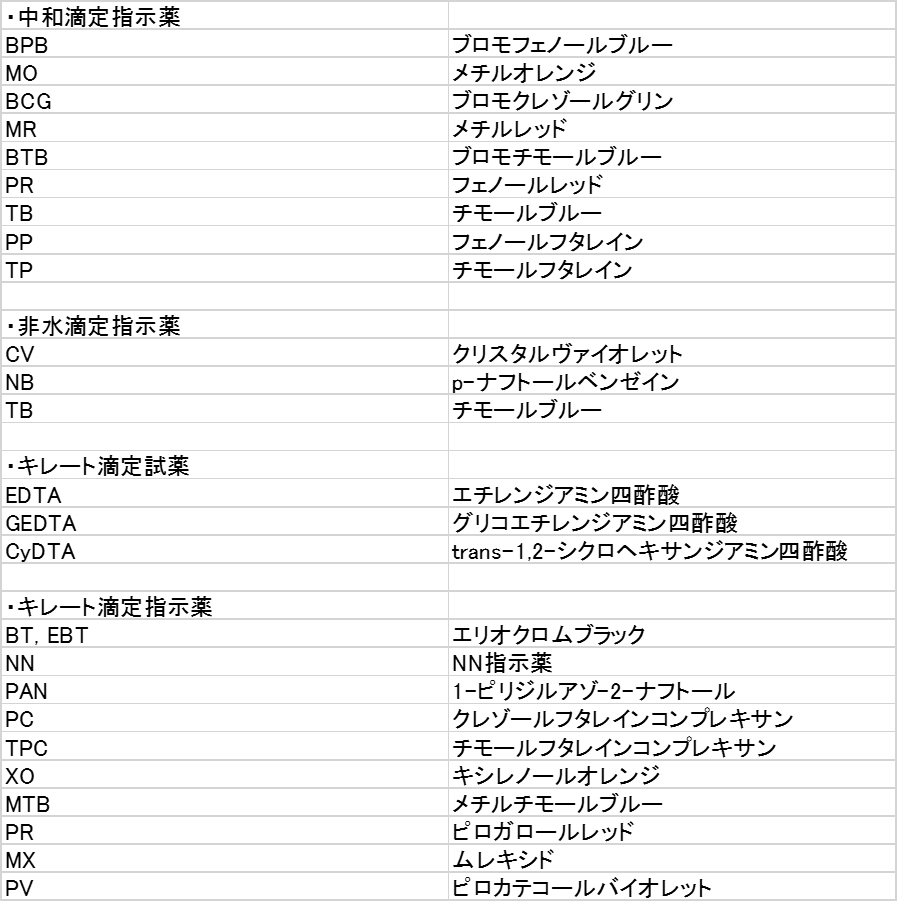



分析化学テスト対策 Noegoism



水の硬度 株式会社ユニケミー ユニラボ




カルシウム マグネシウムの定量法 検査と技術 7巻11号 医書 Jp
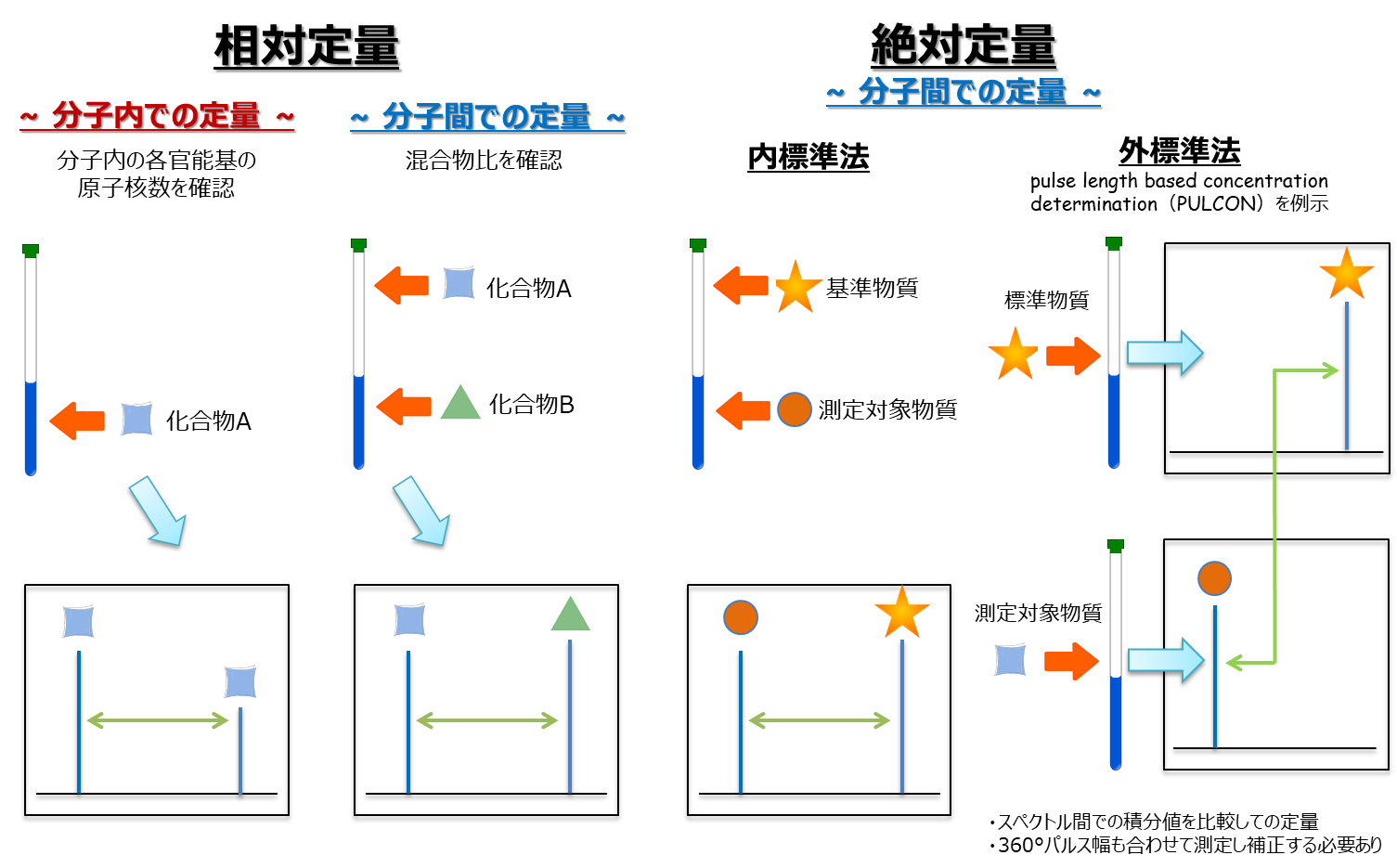



定量nmr Qnmr 核磁気共鳴スペクトル測定 Nmr 分析 試薬 富士フイルム和光純薬
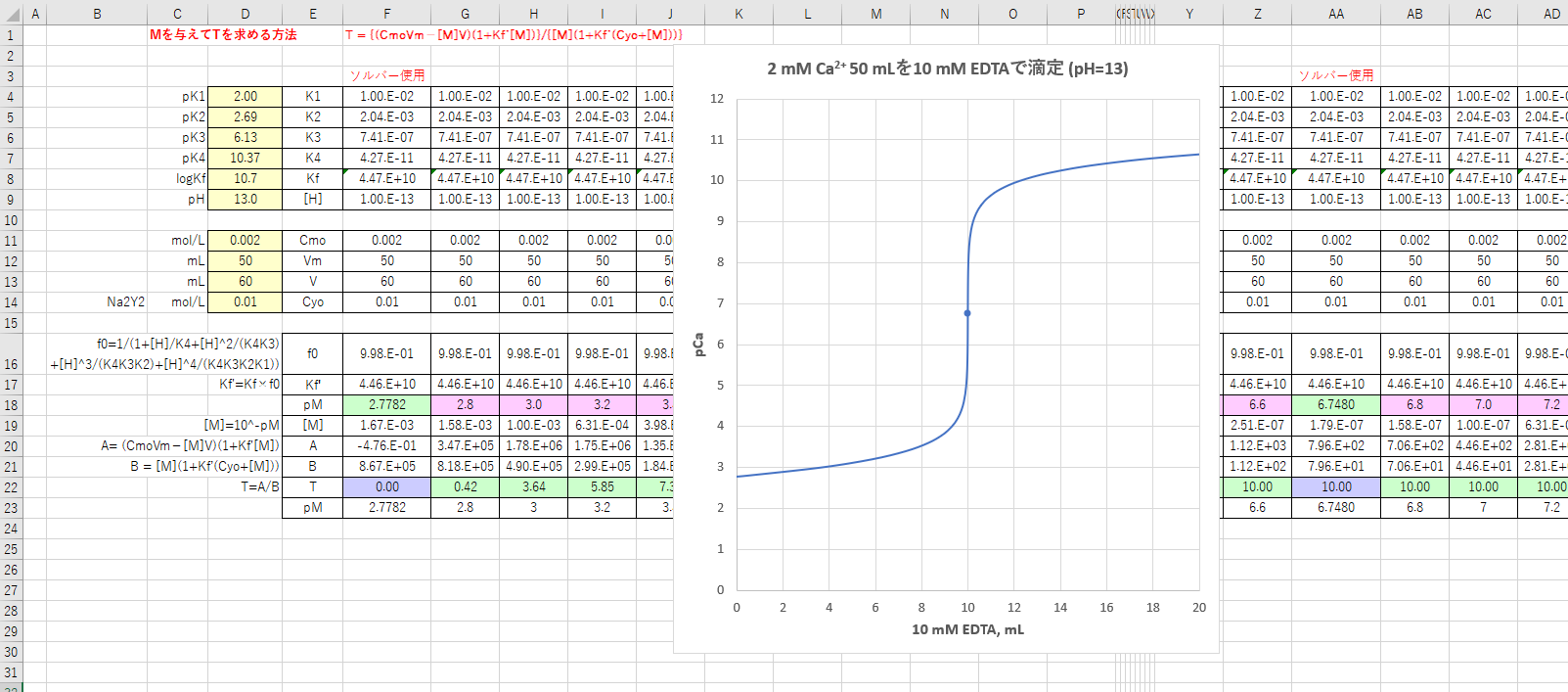



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて




13 号 空気中の二酸化炭素を用いたアルカリ土類金属炭酸塩の製造方法とその利用 Astamuse



Recent Media ファーマ通信予備校 徳島校



No comments:
Post a Comment